게티이미지뱅크
유전자를 편집해 질환을 치료하는 '크리스퍼(CRISPR)' 의학 시대가 도래하고 있다. 지난해 말 영국과 미국에서 연달아 크리스퍼를 활용한 치료제 사용이 승인됐고 크리스퍼를 활용해 각종 질환을 치료하는 데 성공했다는 연구들도 이어지고 있다. 특히 크리스퍼를 이용한 치료법은 유전질환에 매우 유효한 것으로 평가받는다.
인간이 앓는 모든 유전질환을 치료할 날이 머지않았다는 희망적인 전망이 나온다.
15일 과학기술계에 따르면 DNA의 이중나선 구조가 밝혀진 이후 생물 유전자를 조작하는 유전자 조작 기술은 발전을 거듭해왔다. 유전자 조작 기술 중 유전자 편집은 세포의 유전체상 타깃 서열만 정확하게 절단하는 것을 뜻한다. 유전자를 삽입한다는 개념의 '유전자 재조합' 기술과 일부 개념을 공유하지만 원하는 위치를 잘라내고 원하는 유전자를 삽입한다는 개념에서 유전자 편집은 특이점을 가진다.
이렇게 특정한 위치에 있는 DNA를 조작하는 것은 과학계 과제였다. 이런 유전자 편집을 가능하게 한 것이 21세기 생명과학 분야에서 가장 주목받는 '유전자 가위'다. 유전자 가위는 DNA의 특정 서열을 인식해 자르는 '제한효소'가 발견되면서 본격적으로 발전이 이뤄졌다. 가장 먼저 발견된 제한 효소는 'Fokl'이다. Fokl은 세균들이 단백질을 절단할 때 쓰이는 효소다. 여기에 1985년 아프리카발톱개구리의 유전자를 연구하다가 발견된 단백질 '징크핑거(Zinc Finger)'를 결합했다. 구조가 손가락(Finger)을 닮았고 거기에 아연(Zn)이 결합돼 있어 징크핑거란 이름이 붙었다. 징크핑거는 특정 DNA 가닥을 인지한다. 과학자들은 2002년 징크핑거와 Fokl을 결합해 1세대 유전자 가위를 탄생시켰다.
1세대 유전자 가위는 한계점을 가졌다. 설계와 제작 과정이 복잡하다. 그러다 보니 소요되는 비용이 컸다. 사용 중 의도치 않은 DNA를 절단하는 오작동도 발생했다.
이를 일부 개선해 만든 것이 2009년 등장한 2세대 유전자 가위다. '탈렌(Talen)'이란 단백질을 활용했다. 탈렌은 3개 염기서열에 1개씩 결합하는 징크핑거와 달리 1개 염기서열에 1개만 결합할 수 있다. 하지만 탈렌 역시 설계와 제작 과정이 복잡하고 비용이 많이 드는 문제는 여전했다.
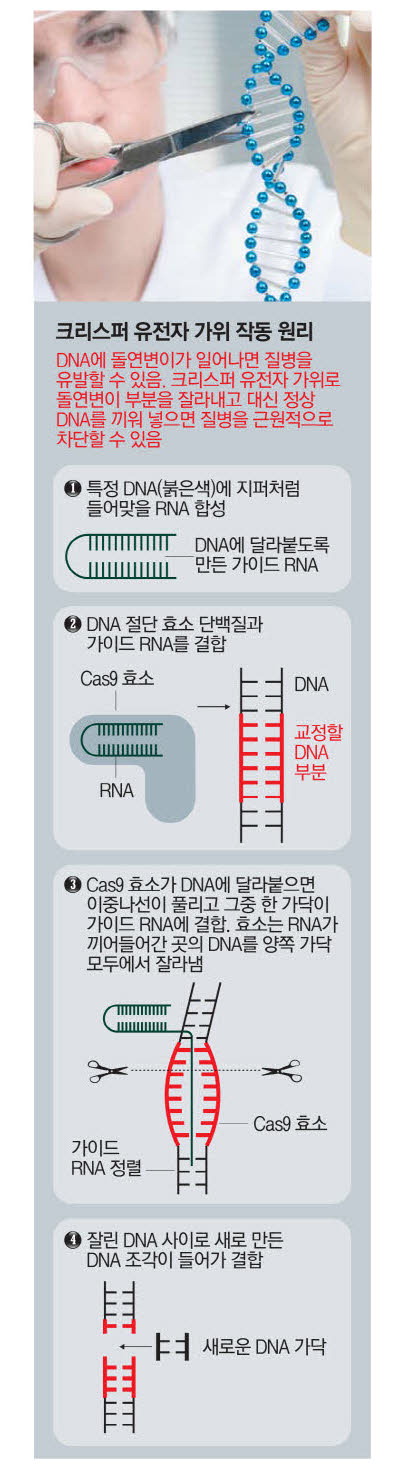
2012년 드디어 3세대 유전자 가위인 크리스퍼가 등장했다. 크리스퍼 유전자 가위는 1·2세대와 달리 단백질이 아닌 RNA가 유전자 서열을 인식한다. RNA는 DNA로부터 만들어지는 핵산으로 DNA의 유전 정보에 상응하는 단백질을 합성할 때 직접적으로 작용하는 고분자 화합물을 의미한다. 유도물질인 RNA가 제한효소, 즉 가위 역할을 하는 Cas9와 붙어 목표 DNA로 이끈다. 길잡이 역할을 하는 RNA만 교체하면 얼마든지 새로운 유전자 가위를 만들 수 있다. RNA는 단백질보다 제작이 간단하다. 간단하다 보니 제작 비용도 저렴하다.
이러다 보니 크리스퍼는 여러 유전자 편집 기술 중 생명과학의 판도를 바꿀 신기술로 큰 주목을 받았다. 인간이 겪는 모든 유전질환에 대해 매우 유효한 치료법으로 평가받는다. 유전질환의 원인 유전자 돌연변이를 고치는 것뿐 아니라 유전자 발현을 제거하거나 조절하는 등 다양한 형태의 치료가 가능하기 때문이다.
이런 가능성과 유용성을 인정받아 이 기술을 개발한 에마뉘엘 샤르팡티에 독일 막스플랑크연구소 연구원과 제니퍼 다우드나 미국 UC버클리대 교수가 2020년 노벨 화학상을 받았다. 크리스퍼 유전자 가위가 생명과학 분야에 가져온 혁명이 엄청났다는 의미다.

크리스퍼 유전자 가위가 등장한 13년 후 마침내 사람에게 쓰일 치료제까지 등장했다. 영국 의약품건강관리제품규제청(MHRA)은 지난해 11월 미국 보스턴 소재 '버텍스파마슈티컬스'와 노벨 화학상 수상자 샤르팡티에 교수가 설립한 스위스 '크리스퍼테라퓨틱스'가 함께 개발한 치료제 '카스제비(Casgevy)'를 겸상적혈구병(SCD) 치료제로 사용 승인했다.
SCD는 유전성 적혈구 질환의 일종이다. 카스제비는 유전자의 DNA 서열 오류를 교정한 세포가 들어 있는 치료제다. 치료제 제작은 먼저 환자의 골수에서 혈액 생성 줄기세포를 채취하는 것부터 시작한다. 그런 다음 실험실에서 세포에 대한 유전자 편집을 거친다. 크리스퍼 유전자 가위를 활용해 'BCL11A'라는 유전자를 절단한다. BCL11A는 원래 태아 때만 생성되는 유전자로, 헤모글로빈의 생성을 막는다. SCD를 일으키는 원인 유전자다. 유전자 편집을 거친 세포를 다시 환자에게 주입한다. 줄기세포가 투여되면 헤모글로빈을 포함하는 적혈구를 생성한다. 일정 시간이 지나면 신체 조직에 산소 공급을 증가시켜 질병을 치료한다. 카스제비는 54명이 참여하는 임상시험을 거쳤다. 치료 1년 후 93%가 적혈구 수혈이 필요하지 않을 정도로 치료 효과가 높은 것으로 나타났다. 카스제비는 영국에 이어 세계 최대 의약품 시장인 미국에서도 승인을 받았다.
크리스퍼 유전자 가위를 활용한 치료제 출시가 줄줄이 기대된다. 노벨 화학상 수상자 다우드나 교수가 설립한 미국 바이오기업 '인텔리아테라퓨틱스'는 심근병증을 동반한 '트랜스티레틴(ATTR) 아밀로이드증' 환자를 위한 치료제를 개발하고 있다. 지난해 10월 미국 식품의약국(FDA)에서 치료제에 대한 3상 임상시험을 승인받았다.
미국 바이오기업 '카리부바이오사이언스'는 크리스퍼 유전자 가위 기반 암 치료제를 개발하고 있다. FDA로부터 3상 임상 허가를 기다리고 있는데, 긍정적인 피드백을 받았다는 게 업체 측 설명이다. 크리스퍼 유전자 가위 분야 대가인 장펑 미국 브로드연구소 교수가 설립한 '빔테라퓨틱스' '에디타스메디슨' 등도 크리스퍼 유전자 가위를 활용한 치료제를 개발하고 있다. 국내에서는 툴젠과 진코어 등이 관련 연구를 진행하고 있다.
한편 최근에 4세대 유전자 가위로 불리는 '프라임'도 주목받고 있다. 생명과학 분야 대혁신이라 불리는 크리스퍼도 약점은 존재한다. 크리스퍼는 DNA 이중가닥을 모두 절단하고 세포가 자체적으로 복구되는 원리로 작동한다. 프라임은 이중가닥 대신 단일가닥만 절단한다. 2개가 아닌 1개만 자른다는 의미다. 그런 다음 세포의 자체 회복 시스템이 아니라 DNA를 덩어리째 삽입한다. 이 때문에 크리스퍼 사용 시 발생하는 이중가닥 절단과 복구 과정 때 의도치 않게 나타나는 유전자 변형을 더 높은 확률로 막을 수 있다.
미국 매사추세츠공대(MIT)와 하버드대가 공동으로 설립한 브로드연구소의 데이비드 리우 교수 연구팀은 지난 8일 프라임을 활용해 시력을 잃는 유전질환을 앓고 있던 생쥐를 치료했다는 연구를 국제학술지 '네이처 바이오테크놀로지'에 발표했다. 연구팀은 이 동물실험을 기반으로 사람을 대상으로 한 치료제를 개발한다는 계획이다.
제약산업 정보서비스기업 '사이트라인'에 따르면 279개 유전자 편집 치료제가 개발되고 있다. 239개가 전임상 단계에 있으며 136개에 대한 임상시험 계획이 발표됐다. 글로벌 시장조사기관 '프리시던스 리서치'에 따르면 전 세계 유전자 편집 시장 규모는 2023년까지 연평균 성장률 15.73%를 보이며 299억3000만달러(약 39조3878억원)로 성장할 것으로 예측된다.
[고재원 기자](ko.jaewon@mk.co.kr)